Tetapan
Kesetimbangan Tekanan Parsial (Kp)
Tetapan kesetimbangan (K) merupakan konstanta (angka/nilai
tetap) perbandingan zat ruas kanan dengan ruas kiri pada suatu reaksi
kesetimbangan. Hukum
kesetimbangan dikemukakan oleh Cato Goldberg dan Peter Wage: “Untuk setiap
sistem kesetimbangan pada suhu tertentu, perbandingan hasil kali konsentrasi
zat hasil reaksi pangkat koefisien masing-masing dengan hasil kali konsentrasi
zat pereaksi pangkat koefisien masing-masing adalah dan tetap”.
Ada dua macam tetapan kesetimbangan, yaitu: KC dan KP.
Untuk reaksi yang melibatkan gas tetapan
kesetimbangan dapat dinyatakan dari harga tekanan parsial masing-masing gas
pada saat setimbang, sebab konsentrasi gas dalam suatu ruangan akan menentukan
besarnya tekanan gas tersebut dalam ruangan. Untuk membedakan harga tetapan kesetimbangan
yang diperoleh dari harga konsentrasi dan dari harga tekanan parsial, maka
untuk selanjutnya harga tetapan
kesetimbangan yang diperoleh berdasarkan
kosentrasi diberi lambang Kc sedangkan untuk tetapan kesetimbangan yang diperoleh dari harga tekanan diberi lambang
Kp.
Tetapan kesetimbangan berdasarkan tekanan parsial disebut tetapan
kesetimbangan parsial dinyatakan dengan Kp (p = pressure, yang berarti
tekanan). Konstanta/tetapan kesetimbangan tekanan (Kp) adalah perbandingan
tekanan parsial produk dan tekanan parsial pereaksi dipangkatkan dengan
koefisien masing – masing pada suatu reaksi kesetimbangan. Untuk sistem kesetimbangan gas, perhitungan
tetapan kesetimbangan dapat dilakukan dengan menggunakan tekanan parsial tiap
gas.
Untuk
reaksi homogen, berlaku:
kA(g)
+ lB(g)
mC(g)
+ nD(g)
Keterangan
:
pA,
pB, pC,pD masing masing merupakan tekanan parsial zat A, B,C, dan D
tekanan
parsial gas ideal, misalnya A, dapat dihitung dengan persamaan berikut :
P
total (tekanan total) ialah penjumlahan seluruh tekanan pada sistem
kesetimbangan (pA + pB + pC + pD)
Untuk
reaksi heterogen berlaku:
tA(s)+
uB(g)
vC(g) + wD(g)
Keterangan
:
pB,
pC,pD masing masing merupakan tekanan parsial zat B,C, dan D
tekanan
parsial gas ideal, misalnya B, dapat dihitung dengan persamaan berikut :
P
total (tekanan total) ialah penjumlahan seluruh tekanan pada sistem
kesetimbangan (pB+pC+pD)
Contoh
:
1. Tentukan
Kp untuk reaksi kesetimbangan 2 NH3 (g)
N2
(g) + 3H2(g) !
Jawab :
Kp =
2. Diketahui
reaksi kesetimbangan
2NaHCO3(s)
Na2CO3 (s) + H2O
(g) + CO2(g)
Jika
pada keadaan setimbang tekanan total = 6 atm, tentukan Kp
Jawab :
Data yang diketahui berupa persamaan reaksi sehingga untuk menghitung Kp tidak
digunakan perbandingan mol, melainkan perbandingan koefisien
PH2O =
=
= 3 atm
PCO2 =
=
= 3 atm
Kp = PH2O x PCO2
= 3 atm x 3 atm = 9 atm
Jadi pada
keadaan setimbang Kp = 9 atm




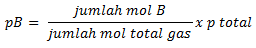
Tidak ada komentar:
Posting Komentar